異なる金属の接触は、サビの原因になることがあります。これを異種金属接触腐食といいます。
たとえば、アルミ素材の部分に鉄のネジを留めるとか、ステンレスの部分に鉄の板を溶接するとか、そんな場合です。
「鉄部に留めてある鉄のネジが錆びて、汚いからステンレスのネジに交換した。」という場合も、知らない間に異種金属の接触を引き起こしていることになります。
では、なぜ、異なる金属が接すると、サビの原因になるのでしょうか?
まずは、通常の状態でサビが発生するメカニズムを見ていきたいと思います。
サビが発生するメカニズム
サビと言ったら、最初に思い浮かべるのは、鉄に発生した赤錆ではないでしょうか?。他にも銅・真鍮・アルミなど様々な金属が酸化しますが、ここでは、サビの代表として鉄が錆びる過程を説明します。
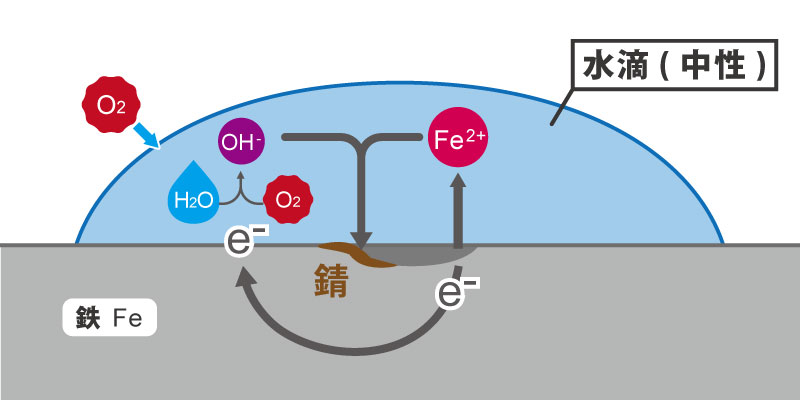
下の図のように、鉄の上に水滴があったとします。
水滴には、空気中の酸素(O₂)が溶け込みます。すると、水(H₂O)と酸素(O₂)は、鉄から電子をもらい、化学反応を起こし、水酸化物イオン(OH⁻)に変化します。
電子と別れた鉄の陽イオン(Fe²⁺)は水滴中に溶出してしまいます。溶出した、鉄(Fe²⁺)は、水と酸素が化合した水酸化物イオン(OH⁻)と反応を起こし、Fe₂O₃となり堆積します。やがて水分が乾くと、これがサビになるわけです。
もともと自然界で鉄は、酸化鉄で存在しています。ここから、人工的に酸素を取り除いて、鉄(鋼)として利用しているわけです。
当然、空気中に酸素と水分が豊富にあれば、鉄は酸化して自然の状態に戻ろうとします。
逆に、酸素と反応して酸化するため、酸素のない真空状態では、サビは発生しなくなります。
これが、普通の状態でサビが発生するメカニズムです。
異種金属の接触でサビが発生する原因は?
貴金属という言葉を聞いた事があると思います。金とかプラチナとか、高価な装飾品のイメージがありますが、これの反対語って知ってますか?
聞きなれない言葉かもしれませんが、貴金属の反対語は、卑金属といいます。
下の表にある通り、金属には、それぞれに電位があり、イオン化(溶出)しやすい順番があります。
基本的に水素を境に、イオン化しにくいものを貴金属、イオン化しやすいものを、卑なる金属と分類します。
貴重な金属だから貴金属であることは確かですが、貴金属はイオン化しにくい安定した金属なのです。逆に、イオン化しやすい金属は、空気中の水分でも、酸素などと結びつき酸化物を作ろうとします。
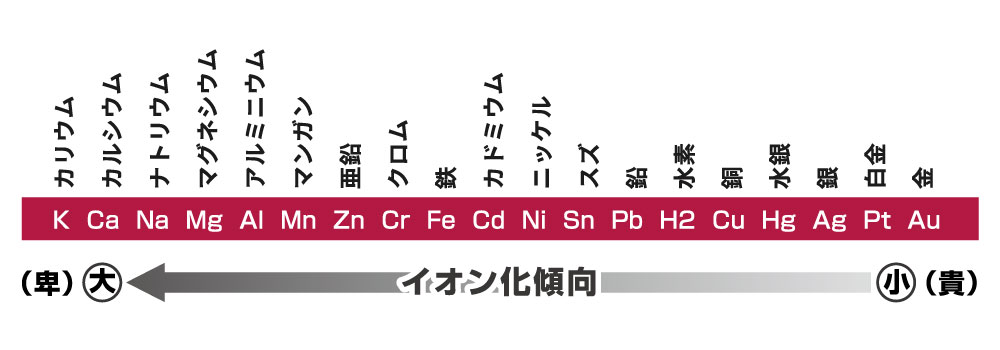
このイオン化しやすいかどうかの順番が、接触サビの発生の原因となるのです。
鉄とアルミニウムが接触した場合
たとえば、鉄とアルミが接触している場合。ここに雨や結露などで水分が付着したとします。
普通であれば、鉄・アルミの両方とも水と酸素の化学反応に電子を取られ、陽イオンは溶出し、腐食へと進んでいきます。
ところが、この例の場合、イオン化傾向の大きい、アルミの方が鉄のイオン化よりも先に電子を放出し、鉄に電子を供給する形になります。
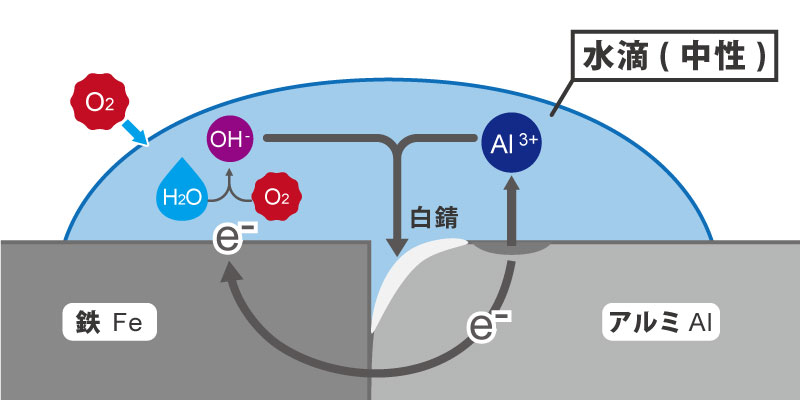
これにより、鉄のイオン化は抑制され、逆にアルミのイオン化は、促進されることとなるのです。
異種金属が接触した場合、イオン化しやすい金属が、イオン化しにくい金属の腐食分も負担することで、よりサビやすくなってしまうというのが、異種金属の接触によるサビの原因です。
電位差による腐食であるため、電蝕とも言います。
イオン化傾向の表で、離れている金属同士の接触ほど、強くこの傾向が現れます。ステンレスは、合金で元素ではないため、イオン化傾向の表にはないですが、電位で言うと、銅と同程度の位置にあります。
アルミの部品を固定するのに、ステンレスのネジを使用する事が多いですが、電位差がかなり大きいため、アルミが溶出してしまうなどのトラブルが発生します。また、ステンレス側も白色化などの現象が現れる場合があります。
電蝕を防ぐには、どうすればいい?
電蝕は、イオン化傾向が大きい金属から小さい金属に電子が移動し、金属の陽イオンが電解質溶液に溶けだして起こるものです。
つまり、異種金属間で微弱な電流が流れてしまう事が原因で腐食が発生しているわけです。
電蝕を防止するには、簡単に言えば、この電流の流れる回路を遮断してしまえば起こらなくなります。
例えば、絶縁体を挟んでみたり、塗装をしたりすれば、電子は移動できなくなります。
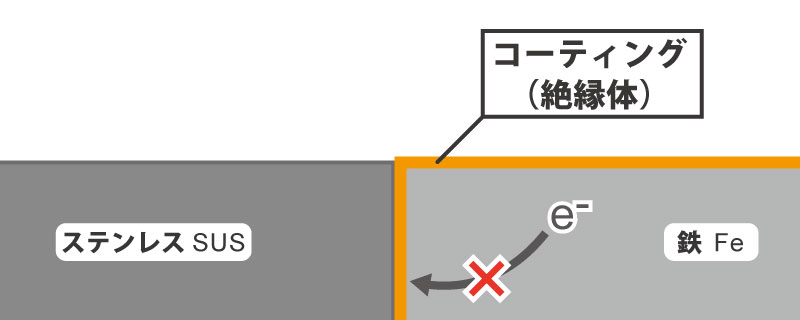
異種金属間で起こる電流は、極微弱なものなので、電流を通さないものであれば、メッキ(コーティング)程度の膜厚でも遮断できます。
電子の移動がなければ、電蝕による腐食は起きなくなります。
メッキには異種金属の接触が応用されている
金属をサビから守る技術のメッキ(鍍金)に、異種金属の接触を応用しているものがあります。
鉄素地へのメッキで、ユニクロメッキという表面処理方法があります。光沢クロメートメッキとも呼ばれていますが、これのベースとなっているのが鉄の表面を亜鉛皮膜で覆う電気亜鉛メッキです。
亜鉛皮膜は、鉄の表層で膜となって守る効果があります。しかし、メッキ表面に傷がついた場合、膜の効果は無くなり、鉄素地が剥き出しになります。
普通であれば、守る膜を失った鉄は、腐食を始めるはずです。ここで亜鉛の力が発揮されるのです。
もう一度、イオン化傾向の表を見てみて下さい。亜鉛は、鉄よりもイオン化傾向が大きい事が分かります。
亜鉛の膜で鉄を覆う電気亜鉛メッキは、異種金属の接触が起きているわけです。亜鉛と鉄が接する事で、亜鉛の電子は鉄に供給される事になります。
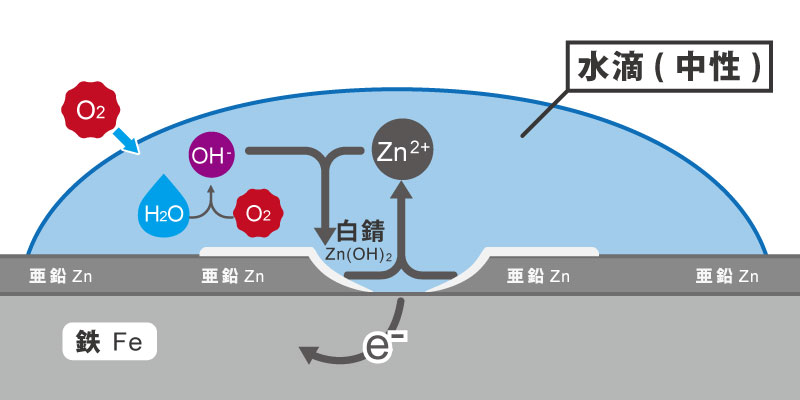
鉄は、亜鉛の電子が供給されることで、腐食の進行を抑制する事ができるわけです。その代わり、亜鉛は、鉄の腐食を遅らせるために犠牲になって、溶出していきます。
これを、犠牲防触といい、異種金属の接触を応用した、表面処理の一例となります。
まとめ
金属のサビが促進してしまう原因は、色々とあります。
塩害であったり、熱の影響であったり。その中で、知らぬ間に影響を与えてしまっているのが異種金属による電蝕ではないでしょうか?
特にステンレスは、鉄部品が錆びてしまった場合の置き換えで使われることがあります。
もともと、鉄に接するような場所に使用されていた場合、片方の部品をステンレスに置き換える事で、接している鉄の腐食を早めてしまうことになります。
接する金属同士の体積の差でも影響は変わってきますが、金属の相性を考えるならば、鉄製品には、鉄の部品といったように、同金属を合わせるのが基本となります。
酸化してしまうと鉄は、もとの想定強度を保持できなくなります。安全上重要な部品であれば、美観だけではなく、腐食の事を良く考えて使用するのが重要です。






